国立研究開発法人国立がん研究センター(本社:東京都中央区)の東病院(千葉県柏市)、中外製薬(本社:東京都中央区)、NTTデータの3社は2024年6月11日、電子カルテの臨床データをEDC(臨床データ収集システム)に連携させる共同研究を実施したと発表した。データ連携の効果として、医療機関では電子カルテからEDCへの転記作業時間や製薬企業からの問い合わせ数が減った。製薬企業ではSDV(Source Data Verification:現資料信頼性検証)の作業時間が減った。
国立がん研究センター東病院、中外製薬、NTTデータの3社は、電子カルテの臨床データをEDC(Electronic Data Capture:臨床データ収集システム)に連携させる共同研究を2023年6月から2024年1月にかけて実施した。目的は、電子カルテに記録した臨床データ(有害事象、併用薬、患者背景、バイタルサイン、臨床検査値)を治験に活用しやすくすること。データ連携により、症例データの報告・収集を効率化する(図1)。
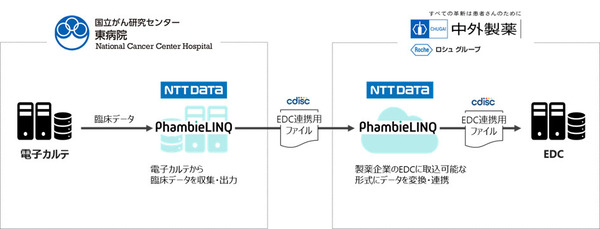 図1:電子カルテと臨床データ収集システムをデータ連携させる共同研究の概要(出典:国立がん研究センター東病院、中外製薬、NTTデータ)
図1:電子カルテと臨床データ収集システムをデータ連携させる共同研究の概要(出典:国立がん研究センター東病院、中外製薬、NTTデータ)拡大画像表示
これまでも、電子カルテに記録した臨床データを製薬企業のEDCに連携させる取り組みは行われてきた。しかし、連携対象の臨床データは限定的で、データ連携の拡充が求められていたという。今回の共同研究では、疾患領域を限定せず、有害事象・併用薬を含め、治験で必要となる主要な臨床データを連携させた。システム要素として、NTTデータが提供している医療機関と製薬会社のデータ連携システム「PhambieLINQ」を用いた。
データ連携による効果は、製薬企業から医療機関への問い合わせ数、医療機関におけるデータ転記時間および製薬企業におけるSDV(Source Data Verification:資料信頼性検証)の作業時間の2つの観点で評価した。この結果、医療機関では、電子カルテからEDCへの転記作業時間や製薬企業からの問い合わせ数が減った。製薬企業ではSDVの時間が減った。
「新薬の開発は平均で9~17年程度かかる。プロセスとして研究、治験での臨床データの収集・解析、有効性と安全性の評価などを経る。このうち、臨床データの収集は、製薬企業と医療機関の双方で多くの労力・時間を費やす作業であり、業務の効率化と品質の確保が課題である」(3社)
こうした中、医療機関の電子カルテから製薬企業のEDCに臨床データを電子的に連携させる取り組みが注目を集めているという。しかし3社によると、電子カルテとEDCの互換性や製品間の差異などが元で業界全体での普及は進んでおらず、なかでも、患者の安全性評価で重要となる有害事象や併用薬情報については、データ連携の取り組みは稀だという。
NTTデータは、医療機関や製薬企業を問わずに電子カルテとEDCをデータ連携可能なシステムとしてPhambieLINQを提供している。連携可能な臨床データは、現状では患者背景、臨床検査値、バイタルサインの3種類。一方、電子カルテには有害事象や併用薬などの情報も記録されている。これらがEDCに電子的に連携可能になれば、治験業務がさらに効率化する。
今回取り組んだ検証結果の具体的な内容は以下のとおりである。電子カルテからEDCへの電子的な連携について3社は、「一定程度可能であり、オペレーションおよび信頼性(データ品質等を含む)の観点から実試験での利用可能性があることを確認した」としている。
- 有害事象:1件あたり、28項目中10項目を連携(36%)
- 併用薬:1薬剤あたり、11項目中8項目を連携(73%)
- 患者背景:1例あたり、11項目中2項目を連携(18%)
- バイタルサイン:1例あたり、30項目中19項目を連携(63%)
- 臨床検査値:1例あたり、145項目中126項目を連携(86%)
医療機関の転記作業時間は、1例あたり1時間程度の削減効果を確認した。製薬企業のSDV作業時間は、1例あたり1.5時間程度の削減効果を確認した。製薬企業からの問い合わせ数については、EDCシステムから自動配信するシステムクエリーが1例あたり11件中6件に減った。手作業でのクエリーは、1例あたり9件中2件に減った。
- 業務システム 2027年4月強制適用へ待ったなし、施行迫る「新リース会計基準」対応の勘所【IT Leaders特別編集版】
- 生成AI/AIエージェント 成否のカギは「データ基盤」に─生成AI時代のデータマネジメント【IT Leaders特別編集号】
- フィジカルAI AI/ロボット─Society 5.0に向けた社会実装が広がる【DIGITAL X/IT Leaders特別編集号】
- メールセキュリティ 導入のみならず運用時の“ポリシー上げ”が肝心[DMARC導入&運用の極意]【IT Leaders特別編集号】
- ゼロトラスト戦略 ランサムウェア、AI詐欺…最新脅威に抗するデジタル免疫力を![前提のゼロトラスト、不断のサイバーハイジーン]【IT Leaders特別編集号】
-

VDIの導入コストを抑制! コストコンシャスなエンタープライズクラスの仮想デスクトップ「Parallels RAS」とは
-

AI時代の“基幹インフラ”へ──NEC・NOT A HOTEL・DeNAが語るZoomを核にしたコミュニケーション変革とAI活用法
-

加速するZoomの進化、エージェント型AIでコミュニケーションの全領域を変革─「Zoom主催リアルイベント Zoomtopia On the Road Japan」レポート
-

14年ぶりに到来したチャンスをどう活かす?企業価値向上とセキュリティ強化・運用効率化をもたらす自社だけの“ドメイン”とは
-

-

-

-

生成AIからAgentic AIへ―HCLSoftware CRO Rajiv Shesh氏に聞く、企業価値創造の課題に応える「X-D-Oフレームワーク」
-

-

-

「プラグアンドゲイン・アプローチ」がプロセス変革のゲームチェンジャー。業務プロセスの持続的な改善を後押しする「SAP Signavio」
-

BPMとプロセスマイニングで継続的なプロセス改善を行う仕組みを構築、NTTデータ イントラマートがすすめる変革のアプローチ
-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-




